

Le cas d’une patiente présentant une forme atypique de syndrome myasthénique congenital avec l’identification d’une nouvelle mutation dans le gène LRP4 vient d’être publié dans la revue Science Reports*. Fruit d’une collaboration étroite entre des scientifiques français comprenant des cliniciens du service de Neuro-Myologie et les chercheurs du Centre de Recherche en Myologie, l’article fait le lien entre les manifestations cliniques variées de la maladie et les voies de signalisations impliquées à la jonction neuromusculaire (JNM) perturbées par la mutation du gène. Entretien avec Dr Marion Masingue**, MD et Stéphanie Bauché***, PhD.
Dans quel contexte avez-vous mené ces travaux ?
Marion Masingue. Nous avons identifié, dans notre cohorte française de patients atteints de syndrome myasthénique congénital (SMC), une patiente arrivée dans le service de Neuro-Myologie atteinte d’un syndrome de Cenani-Lenz (agénésie des membres et une malformation rénale) qui présentait une grande fatigabilité et donc une suspicion de myopathie congénitale.
Comment avez-vous procédé et quels résultats avez-vous obtenus ?
MM. Nous avons mené les explorations cliniques classiques et avons finalement suspecté un syndrome myasthénique congénital. Puis nous avons décidé de pousser les investigations pour faire des tests plus spécifiques, de la JNM en particulier, suite à des discussions autour de ce cas avec des collègues du Réseau SMC****. Les données physiologiques obtenues, associées aux données histologiques et au diagnostic génétique par NGS ont permis de confirmer qu’il s’agissait bien d’un SMC lié à une nouvelle mutation dans un gène connu, LRP4.
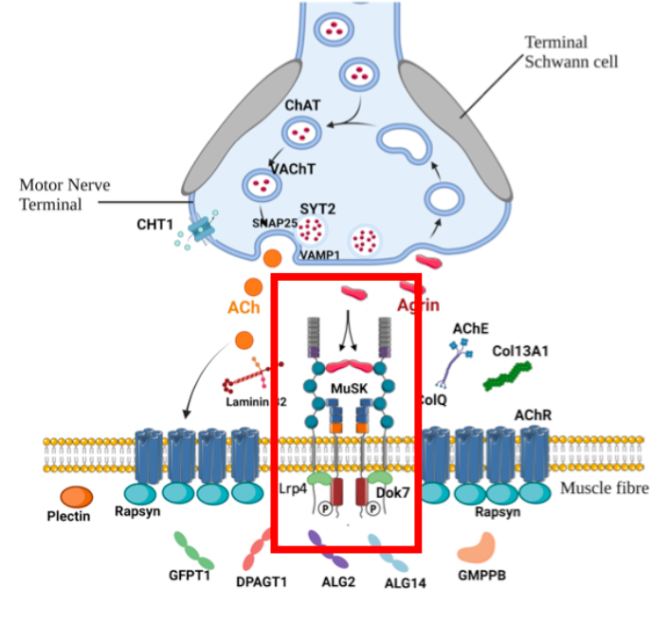 Stéphanie Bauché. D’un point de vue fonctionnel et moléculaire, le domaine de la protéine LRP4 muté a un rôle important dans la voie de signalisation Agrine/LRP4/MuSK qui est impliquée dans la formation et la maintenance de la jonction neuromusculaire (JNM). Cette protéine fait partie de la famille de protéines LRP qui sont exprimées de façon très précoce et sont connues pour être impliquées dans la morphogénèse des membres. Le domaine identifié dans ce cas n’avait jamais été rapporté comme responsable d’un SMC.
Stéphanie Bauché. D’un point de vue fonctionnel et moléculaire, le domaine de la protéine LRP4 muté a un rôle important dans la voie de signalisation Agrine/LRP4/MuSK qui est impliquée dans la formation et la maintenance de la jonction neuromusculaire (JNM). Cette protéine fait partie de la famille de protéines LRP qui sont exprimées de façon très précoce et sont connues pour être impliquées dans la morphogénèse des membres. Le domaine identifié dans ce cas n’avait jamais été rapporté comme responsable d’un SMC.
Les expériences menées in vitro, en particulier sur des cellules hétérologues ou des cellules musculaires de biopsie de la patiente ont montré une diminution de la liaison de l’agrine au domaine muté de LRP4 ainsi qu’une diminution de l’agrégation des récepteurs à l’acetylcholine (RACh) induit par l’agrine, entrainant une diminution de la voie de signalisation Agrine/LRP4/MuSK pouvant expliquer la neurotransmission diminuée (décrément) chez la patiente associée à ses symptômes de faiblesse et de fatigabilité musculaire.
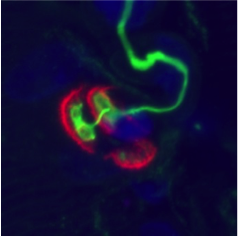
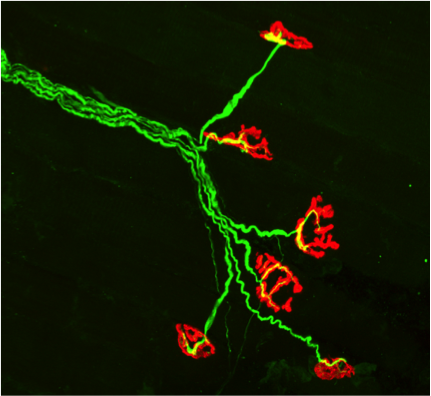 Par ailleurs, dans les mêmes systèmes d’étude nous avons montré une diminution de la liaison de Wnt11 au domaine muté expliquant l’agénésie des membres observé chez la patiente. Nous avons ainsi prouvé que le domaine muté de LRP4 était bien responsable de la perturbation de la voie de signalisation agrine/LRP4/MuSK et donc du SMC atypique chez la patiente mais également d’un point de vue plus fonda-mental que ce domaine de LRP4 était acteur dans une autre voie de signalisation mal connue, la voie Wnt.
Par ailleurs, dans les mêmes systèmes d’étude nous avons montré une diminution de la liaison de Wnt11 au domaine muté expliquant l’agénésie des membres observé chez la patiente. Nous avons ainsi prouvé que le domaine muté de LRP4 était bien responsable de la perturbation de la voie de signalisation agrine/LRP4/MuSK et donc du SMC atypique chez la patiente mais également d’un point de vue plus fonda-mental que ce domaine de LRP4 était acteur dans une autre voie de signalisation mal connue, la voie Wnt.
Schéma de la JNM avec la voie Agrine/LRP44/MuSK.
Photos d’immunomarquages de JNM humaines.
Comment cette découverte peut-elle améliorer la vie des patients ?
 MM. L’originalité de ce travail réside dans le fait que nous nous trouvions devant un tableau clinique très atypique en deux parties : un SMC avec des symptômes musculaires, et un syndrome de Cenani-Lenz avec une partie malformative. Ces deux tableaux avaient déjà été décrits distinctement mais jamais associés l’un à l’autre. Les échanges avec le réseau SMC ont été essentiels et nous ont permis de poursuivre les recherches sur le plan moléculaire, de valider l’implication de cette nouvelle mutation dans le tableau clinique de la patiente, et in fine d’en apprendre plus sur la voie Wnt, et donc plus largement sur la physiopathologie des SMC. Comme l’association entre symptômes malformatifs et myasthénie congénitale n’était pas connue, il existe probablement un certain nombre de personnes atteintes de syndrome de Cenani-Lenz, qui ont également un SMC et pourraient bénéficier d’un traitement ciblé. Ces patients sont peut-être un peu moins rares qu’on ne le pense…
MM. L’originalité de ce travail réside dans le fait que nous nous trouvions devant un tableau clinique très atypique en deux parties : un SMC avec des symptômes musculaires, et un syndrome de Cenani-Lenz avec une partie malformative. Ces deux tableaux avaient déjà été décrits distinctement mais jamais associés l’un à l’autre. Les échanges avec le réseau SMC ont été essentiels et nous ont permis de poursuivre les recherches sur le plan moléculaire, de valider l’implication de cette nouvelle mutation dans le tableau clinique de la patiente, et in fine d’en apprendre plus sur la voie Wnt, et donc plus largement sur la physiopathologie des SMC. Comme l’association entre symptômes malformatifs et myasthénie congénitale n’était pas connue, il existe probablement un certain nombre de personnes atteintes de syndrome de Cenani-Lenz, qui ont également un SMC et pourraient bénéficier d’un traitement ciblé. Ces patients sont peut-être un peu moins rares qu’on ne le pense…
SB. C’est un peu la finalité de tout ce travail : publier pour étoffer les connaissances globales sur les SMC et ouvrir la possibilité pour tout médecin d’identifier, de diagnostiquer et finalement de proposer de nouvelles thérapeutiques afin d’améliorer la vie des malades. Publier est la seule façon de communiquer avec les médecins qui vont voir ces patients.
** Marion Masingue est neurologue et exerce dans le service de Neuro-Myologie et au Centre de Référence des Maladies neuromusculaires Nord-Est-Ile de France.
*** Stéphanie Bauché est ingénieure de recherche au Centre de Recherche en Myologie, dans l’équipe Voies de signalisation et muscles striés dirigée par Antoine Muchir. Les travaux présentés ici ont été réalisés lorsqu’elle faisait partie de l’équipe Connectivité neuromusculaire en santé et pathologies dirigée par Bertrand Fontaine et Laure Strochlic.
**** Le réseau national Syndromes myasthéniques congénitaux a été créé en 2002 et regroupe cliniciens (neurologues, neuropédiatres), pathologistes, généticiens et neurobiologistes qui travaillent en synergie pour mieux comprendre ces pathologies, identifier de nouvelles mutations et prouver leur pathogénicité. Il est actuellement animé par Arnaud Isapof. Des réunions de concertation pluridisciplinaires (RCP) sont régulièrement organisées pour discuter de cas cliniques.
