
Eline Lemerle a réalisé sa thèse* sous la direction de Stéphane Vassilopoulos, dans l’équipe de Marc Bitoun (Organisation de la cellule musculaire et thérapie de la myopathie centronucléaire autosomique dominante) au Centre de Recherche en Myologie de l’institut. Ses travaux, portant sur la formation des tubules T dans la cellule musculaire et plus spécifiquement sur le rôle des cavéoles, viennent d’être publiés dans la revue eLife**. Entretien avec Eline Lemerle et Stéphane Vassilopoulos.
Quel est le contexte de ces travaux ?
Les tubules T sont des invaginations du sarcolemme et constituent un compartiment très spécialisé de la cellule musculaire. Les mutations des protéines impliquées dans la formation ou dans le fonctionnement de ces tubules T sont associées à nombre de myopathies congénitales et dystrophies musculaires, et même au-delà, les défauts et les dysfonctionnements des tubules T sont impliqués dans d’autres dystrophies musculaires de façon indirecte.
Fig.1
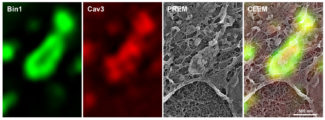 Le tubule T entouré de deux cisternes terminales du réticulum sarcoplasmique forment une triade, une structure membranaire hautement spécialisée nécessaire au couplage excitation-contraction caractéristique de la cellule musculaire. Si nous connaissons les éléments qui forment la triade (Bin1***, cavéoles, les canaux calcium Ryr1, …), nous n’avons pas encore compris à quel moment du développement, comment ou par quel mécanisme elles se forment. La seule chose que nous savons est que l’accumulation des cavéoles au niveau de la membrane plasmique est l’étape initiale de la formation de tubules T, et qu’à un moment donné, Bin1 entre en jeu et donne la forme de tubule à la membrane. Mais, par exemple, le moment où le réticulum sarcoplasmique se connecte avec les tubules n’est pas connu.
Le tubule T entouré de deux cisternes terminales du réticulum sarcoplasmique forment une triade, une structure membranaire hautement spécialisée nécessaire au couplage excitation-contraction caractéristique de la cellule musculaire. Si nous connaissons les éléments qui forment la triade (Bin1***, cavéoles, les canaux calcium Ryr1, …), nous n’avons pas encore compris à quel moment du développement, comment ou par quel mécanisme elles se forment. La seule chose que nous savons est que l’accumulation des cavéoles au niveau de la membrane plasmique est l’étape initiale de la formation de tubules T, et qu’à un moment donné, Bin1 entre en jeu et donne la forme de tubule à la membrane. Mais, par exemple, le moment où le réticulum sarcoplasmique se connecte avec les tubules n’est pas connu.
Fig.2
 Quel était l’objectif de cette l’étude et quels résultats avez-vous obtenus ?
Quel était l’objectif de cette l’étude et quels résultats avez-vous obtenus ?
Notre objectif était donc de réexaminer le mécanisme de la formation des tubules T dans la cellule musculaire et en particulier le rôle des cavéoles. Il nous fallait pour cela trouver des expériences inédites et modifier notre regard pour produire de nouvelles connaissances. Pour cela nous avons examiné la composition à l’échelle nanométrique des tubules T naissants par une technique de microscopie corrélative combinant la fluorescence super-résolution, la microscopie à fluorescence et la microscopie électronique sur des répliques de platine (PREM). Ces techniques ont été appliquées à des myoblastes contrôle et à des myoblastes de muscles squelettiques humains et murins génétiquement modifiés, différenciés en myotubes multinucléés suffisamment longtemps pour que ces structures aient le temps de se former.
Fig.3
 Quelles conclusions en avez-vous tiré ?
Quelles conclusions en avez-vous tiré ?
Nos résultats montrent que, au niveau de la membrane plasmique, Bin1 et les cavéoles composées de cavéoline-3 (Cav3) s’assemblent en structures annulaires d’où émergent des tubes. L’expression de Bin1 conduit à la formation à la fois d’anneaux et de tubes. Nous avons montré que Bin1 forme des échafaudages sur lesquels les cavéoles s’accumulent pour former le tubule T initial. Le déficit en Cav3 entrainé par l’extinction du gène ou par des mutations pathogènes génère à la fois la formation d’anneaux défectueux et la désorganisation de la tubulation médiée par Bin1.
Ces travaux nous ont permis de mettre en évidence de nouveaux mécanismes qui pourraient s’avérer utiles pour mieux comprendre la physiopathologie des myopathies causées par un dysfonctionnement de Cav3 ou de Bin1 et nous permettront de mieux cibler des stratégies thérapeutiques pour plusieurs myopathies différentes qui ont en commun les anomalies des tubules-T.
Fig.1 : Marquage immunofluorescent d’un anneau de cavéoles dans un myotube murin transduit avec Bin1-GFP (vert) et marqué avec des anticorps dirigés contre Cav3 (rouge) observé par microscopie photonique de super-résolution. La dernière image de droite montre la superposition (microscopie corrélative) des images de super-résolution avec l’image de l’ultrastructure obtenue par microscopie électronique sur réplique de platine (PREM).
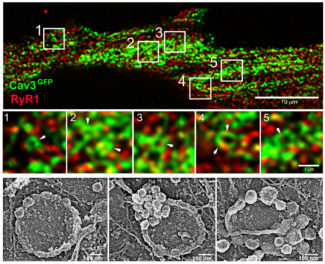
Fig.2 : (Haut) Images en super-résolution d’un myotube humain exprimant Cav3-GFP décapé par des ultrasons et marqué avec des anticorps contre le canal calcique RyR1 (rouge). Les anneaux marqués par Cav3 sont indiqués par des pointes de flèche blanches.
(En bàs) Galerie d’images de microscopie électronique sur réplique de platine d’anneaux formés par des cavéoles dans des myotubes humains.
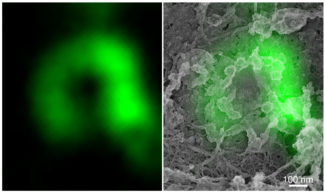
Fig.3 : (Gauche) Image de microscopie à fluorescence en super-résolution d’un anneau marqué par Cav3.
(Droite) Superposition du marquage de Cav3 avec l’image de microscopie électronique PREM.
* « Rôle des cavéoles dans la formation des tubules-T et dans la physiopathologie des cavéolinopathies »
*** Bin1 est muté dans la forme récessive de la myopathie centronucléaire. Des défauts de l’épissage de l’exon 11 (celui qui permet ici de tubuler) ont été découverts dans la DM1 par l’équipe de Denis Furling (Fugier et al., Nat Medecine)
