Bruno Cadot, chercheur dans l’équipe de Marc Bitoun au Centre de recherche en myologie, a mené à bien l’acquisition d’un nouveau microscope pour le compte de l’institut. Dix-huit mois se sont écoulés entre les premières demandes de financement et la mise en service. Depuis que le microscope a été inauguré, le mois dernier, chercheurs et cliniciens se succèdent pour l’utiliser.
Que s’est-il passé pendant 18 mois ?
En juillet 2016, l’appel à projets de la région Île de France, DIM Biothérapies, a été lancé qui subventionne à hauteur de 66% le montant de l’achat d’un équipement. Les 33% restant ont été pris en charge par l’AIM. Entre la réponse à l’appel à projets, les étapes successives de sélection des projets, la recherche de financements complémentaires, le test des microscopes répondant aux critères retenus proposés par les différents fournisseurs, la commande de l’appareil choisi et son installation, 18 mois s’étaient écoulés.
Pourquoi était-il essentiel d’acquérir un tel matériel ?
Si l’institut dispose de très bons microscopes électroniques (ME), un microscope confocal à fluorescence manquait car, contrairement au ME, il permet d’observer des cellules vivantes. Pour ce type d’observation, les équipes de l’institut devaient jusque-là louer les microscopes confocaux d’un plateau technique voisin. Notre nouveau microscope réunit les technologies les plus récentes et les plus performantes : meilleure résolution, temps de pose considérablement réduit pour les prises de vue, champ plus large, possibilité de filmer les mouvements sur matériau vivant (protéines à l’intérieur de cellules, cellules dans un tissu, et même petits organismes entiers comme la larve de zebrafish). Toutes les équipes peuvent avoir l’usage de ce microscope dont la prise en main est simple et rapide grâce à une ou deux heures de formation.
Comment allez-vous l’utiliser ?
Pour ma part, je vais suivre la déformation de l’enveloppe des noyaux et ainsi différencier les protéines situées à l’intérieur et à l’extérieur de l’enveloppe du noyau, voir si elles interagissent, et comment elles modifient leur position dans l’enveloppe nucléaire au cours de la migration des noyaux par exemple.
Mais il est également possible de reconstituer une image tridimensionnelle l’organisation intérieure d’une fibre musculaire et l’organisation entre les fibres. De visualiser en 3D comment des agrégats de protéines se placent dans le noyau, où ils se situent, quelle est leur taille, avoir une quantité d’informations beaucoup plus importante que ce que l’on avait avant.
Il est aussi possible de réaliser des mosaïques d’images afin de faire des analyses statistiques à partir de diverses mesures : taille, forme, distance entre différentes structures. Si l’on observe les cellules vivantes en « live », on a la possibilité d’évaluer les déplacements, la vitesse, les rencontres, les fusions, les séparations, c’est infini en fait !
Fig.1. Le microscope est un Nikon Ti2 couplé à une tête Yokogawa CSU-W1, un module super-résolution Live-SR de chez Gataca Systems et équipé de deux caméras, une Prime 95B de chez Photometrics et une DS-Ri2 de chez Nikon. Le maintien en température et CO2 est obtenu grâce à un dispositif de chez Oko-Lab.
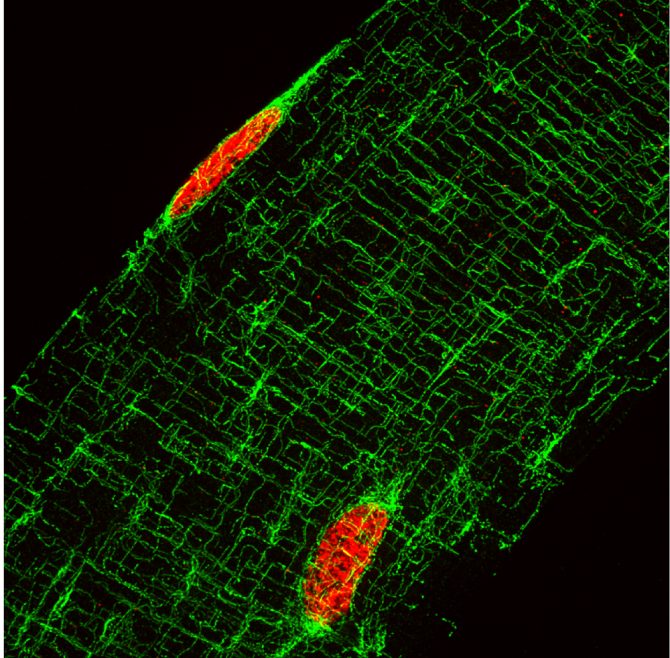
Fig.2. Projection de 35 images, 3,5um d’épaisseur totale, prises en z d’une fibre musculaire isolée, marquée pour les microtubules en vert et les noyaux en rouge. On distingue très bien le réseau très organisé de ce cytosquelette.
Propos recueillis par Anne Berthomier