 Bruno Cadot, chercheur au Centre de Recherche en Myologie et responsable de la plateforme technologique MyoImage, a supervisé l’acquisition d’un microscope confocal dernière génération Nikon AXR-NSPARC assorti d’un module de super résolution N-STORM*. Ce nouvel appareil ultra performant vient enrichir le parc d’équipements d’imagerie de pointe et d’analyse d’images de la plateforme. Entretien avec Bruno Cadot
Bruno Cadot, chercheur au Centre de Recherche en Myologie et responsable de la plateforme technologique MyoImage, a supervisé l’acquisition d’un microscope confocal dernière génération Nikon AXR-NSPARC assorti d’un module de super résolution N-STORM*. Ce nouvel appareil ultra performant vient enrichir le parc d’équipements d’imagerie de pointe et d’analyse d’images de la plateforme. Entretien avec Bruno Cadot
Quelles sont les caractéristiques de votre nouveau microscope confocal ?
Un microscope à fluorescence utilise les propriétés d’émission d’une longueur d’onde spécifique de certaines protéines ou de fluorophores une fois excités par une longueur d’onde moins longue. Par rapport à un microscope à fluorescence classique, à champ large, le microscope à fluorescence confocal permet de s’affranchir de la lumière émise en dehors du plan focal de la zone observée et ainsi obtenir des images de très haute qualité. En général, la lumière émise est collectée par un détecteur qui transforme la quantité de photons reçus en image. La solution acquise utilise 25 detecteurs ce qui permet d’obtenir une image encore plus fine et mieux contrastée afin de mieux caractériser les structures biologiques.
Toutefois, à cause des propriétes physiques de la lumière, la microscopie à fluorescence se limite à séparer des éléments d’une taille supérieure à 200 nanomètres (nm), c’est-à-dire que si deux objets sont situés à moins de 200 nm d’écart, on ne pourra pas les discerner et l’on ne verra donc qu’un seul objet. Or de nombreuses structures biologiques mesurent moins de 200 nm, et la seule alternative possible pour les observer est actuellement d’utiliser un microscope électronique. Avec une résolution pouvant aller jusqu’à 5 nm, elle ne permet cependant d’observer que les structures en niveaux de gris, à la différence de la microscopie à fluorescence avec laquelle on peut voir les différentes protéines que l’on a choisi d’observer en les colorant ou en les marquant. J’ai donc pris le parti d’ajouter un module de super-résolution STORM intégré à ce nouveau microscope confocal, afin de dépasser cette barrière de résolution et ainsi atteindre 20 ou 30 nm.
Comment cela fonctionne-t-il ?
Pour utiliser le module STORM, qui signifie Stochastic Optical Reconstruction Microscopy, on utilise des fluorophores capables de clignoter. On enregistre ainsi une succession d’images des différents fluorophores qui vont clignoter de manière aléatoire (stochastique), un peu comme la tour Eiffel le soir. Chaque clignotement va correspondre à plusieurs pixels sur l’image mais on ne va garder que le centre de ce nuage. En cumulant entre 100 et 1000 images, nous sommes capables de reconstruire une image hyper résolue, et ainsi descendre la limite de résolution autour de 20 nm!
 Dans le cadre de quels projets allez-vous l’utiliser ?
Dans le cadre de quels projets allez-vous l’utiliser ?
Je travaille sur l’enveloppe nucléaire et ce microscope va donc me permettre de mieux comprendre comment le réseau de lamines y est organisé, quelles sont les interactions ou encore quel est l’impact des mutations sur cette organisation, dans le muscle sain et le muscle malade.
Toutes les équipes de recherche de l’Institut vont s’en servir, car aujourd’hui, le confocal est en quelque sorte devenu le microscope « de routine » pour tous les projets. Par exemple, que ce soit dans la DM1 dues à des agrégats d’ARN ou dans la SLA qui présente des agrégats dans les cellules neuronales, il est pour l’instant presque impossible de discerner la distribution et l’organisation de leurs composants, cette nouvelle technologie de super résolution apportera un nouvel éclairage, tant sur la compréhension de ces maladies, que sur d’autres projets étudiant des structures sub-cellulaires.
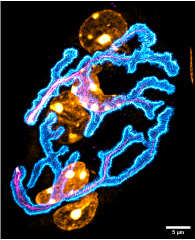
Fig.1. Image acquise au microscope Confocal N-SPARC
 Ce microscope pourrait-il servir au-delà de la recherche fondamentale ?
Ce microscope pourrait-il servir au-delà de la recherche fondamentale ?
Le STORM pourrait devenir en effet également un outil d’aide au diagnostic pour les cliniciens. Si ce n’est pas l’objectif premier pour l’instant, il serait envisageable d’utiliser les éléments clés observés à ces niveaux de résolution pour encore mieux comprendre et caractériser des pathologies.
En faisant un diagnostic plus précis au niveau cellulaire, donc très en amont, on pourrait ainsi permettre une éventuelle intervention à un niveau précoce, avant que des effets plus importants se produisent sur l’ensemble du muscle.
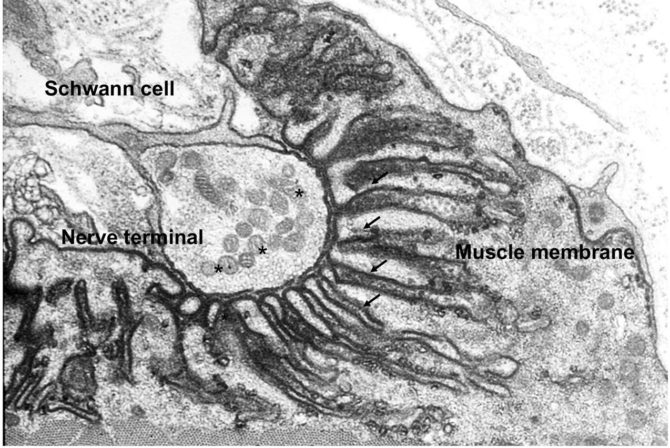
Fig.2. Image acquise en microscopie électronique
* L’acquisition de ce nouveau microscope confocal dernière génération a pu être réalisée en partie grâce à un financement important de notre partenaire Peugeot Invest.
La jonction neuromusculaire est une structure permettant de transmettre le stimulus de contraction provenant du cerveau d’une terminaison nerveuse à la fibre musculaire. L’interface entre ces deux types cellulaires est déterminante et sa structure caractérise une situation saine ou pathologique.
Fig.1. Confocal N-SPARC : image acquise en microscopie à fluorescence confocale N-SPARC pour le récepteur à l’acétylcholine (cyan), nerf (magenta) et les noyaux (jaune). Les détails de la distribution des récepteurs se distingue, en particulier les gouttières, les petites structures correspondantes aux invaginations de la membrane plasmique. Les structures hors-plan ne sont pas visibles. © Bruno Cadot
Fig.2. Image acquise en microscopie électronique montrant la terminaison nerveuse au niveau de la membrane de la fibre musculaire. Les gouttières ou invaginations de la membrane plasmique sont visibles (flèches). © NMJ Frontiers
