
 Satish Babu Moparthi, post-doctorant, et Stéphane Vassilopoulos, co-directeur de l’équipe « Organisation des cellules musculaires et thérapie de la myopathie centronucléaire dominante » du Centre de Recherche de l’Institut de Myologie viennent de publier un article dans la revue Science* en collaboration avec l’équipe de Christophe Leterrier (Université Aix-Marseille, CNRS). Ils ont mis en évidence un mécanisme jusque-là inconnu d’endocytose au niveau de l’axone grâce à la combinaison de deux technologies de pointe. – Entretien avec Stéphane Vassilopoulos
Satish Babu Moparthi, post-doctorant, et Stéphane Vassilopoulos, co-directeur de l’équipe « Organisation des cellules musculaires et thérapie de la myopathie centronucléaire dominante » du Centre de Recherche de l’Institut de Myologie viennent de publier un article dans la revue Science* en collaboration avec l’équipe de Christophe Leterrier (Université Aix-Marseille, CNRS). Ils ont mis en évidence un mécanisme jusque-là inconnu d’endocytose au niveau de l’axone grâce à la combinaison de deux technologies de pointe. – Entretien avec Stéphane Vassilopoulos
Comment est née votre collaboration avec Christophe Leterrier ?
L’histoire commence en 2016 quand j’ai contacté Christophe Leterrier, un chercheur en neurobiologie qui travaille sur l’ultrastructure des neurones via une technique de microscopie photonique en super-résolution (SR) STORM (qui a valu à ses inventeurs le Prix Nobel de chimie en 2014). J’avais à ce moment réussi à décaper des neurones avec la technique de réplique de métal que l’on utilise dans notre laboratoire**, et c’était tellement beau, c’était tellement inattendu de voir les neurones comme cela que j’ai contacté Christophe pour lui envoyer ces photos et lui proposer de travailler ensemble. Nous avons donc décidé de collaborer sur un projet extrêmement précis : visualiser les anneaux d’actine régulièrement espacés le long de la membrane de l’axone. Jusque-là en effet, ils n’avaient pu être aperçus qu’en SR mais jamais en microscopie électronique haute-résolution, ce qui, pour certains chercheurs, jetait un doute sur leur existence et relevait plutôt pour eux d’un artefact lié à la reconstruction de l’image en super-résolution.
Comment avez-vous procédé ?
Chacun a utilisé sa technique : dans un premier temps, Christophe a décapé les neurones à Marseille et les a imagés avec la SR STORM, puis me les a envoyés à Paris où je les ai imagés avec la microscopie électronique. C’était magnifique : dans le neurone, l’actine formait des rayons, espacés précisément de 180 nm, qui faisaient comme des petites échelles. C’était la première fois qu’on les voyait à cette résolution.
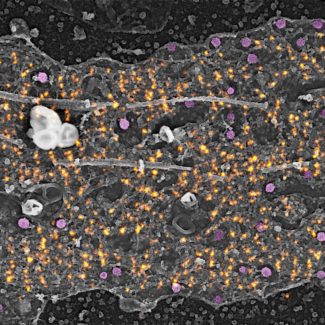 Nous avons alors poussé les travaux plus loin (et c’est unique au monde !) et d’abord il a pris des images des neurones en SR à Marseille : il a décapé les neurones, marqué l’actine, l’a imagée sur un seul neurone sur lequel il a mis un repère dans le but afin que je le retrouve, pour observer ce même neurone de la microscopie électronique. Ensuite nous avons superposé son image d’actine à l’échelle nanométrique en SR et mon image de neurone en microscopie électronique sur laquelle on visualise sa structure à cette même échelle. Ces travaux ont été publiés dans Nature Communications** en décembre 2019.
Nous avons alors poussé les travaux plus loin (et c’est unique au monde !) et d’abord il a pris des images des neurones en SR à Marseille : il a décapé les neurones, marqué l’actine, l’a imagée sur un seul neurone sur lequel il a mis un repère dans le but afin que je le retrouve, pour observer ce même neurone de la microscopie électronique. Ensuite nous avons superposé son image d’actine à l’échelle nanométrique en SR et mon image de neurone en microscopie électronique sur laquelle on visualise sa structure à cette même échelle. Ces travaux ont été publiés dans Nature Communications** en décembre 2019.
Et pour ce qui est des travaux récemment publiés dans Science ?
C’est en observant les anneaux d’actine dans l’axone que nous avons découvert qu’il y avait des puits de clathrine le long de l’axone, alors qu’il était admis jusque-là que dans le neurone, il n’y en avait qu’au niveau des synapses et du corps cellulaire. En outre, ces puits recouverts de clathrine n’étaient pas classiques mais seulement présentes au niveau de structures que nous avons appelées « clairières », formées par une interruption du maillage sous-membranaire de spectrine, qui protège la membrane de l’axone. Ces clairières permettent à la clathrine d’accéder à la membrane pour faire de l’endocytose.
Cependant, en condition basale, nous n’avons pas observé d’endocytose à ce niveau, c’est ultra-stable. Il y a compétition entre la spectrine et la clathrine, et le maillage s’oppose à l’endocytose. Pour montrer qu’il y avait endocytose, nous avons utilisé une molécule chimique (NMDA) qui induit une forte activité neuronale, laquelle active l’endocytose. En d’autres termes, lorsque le neurone commence à fonctionner et transmet des courants électriques, une endocytose se met rapidement en place pour moduler les protéines présentes à la surface du neurone. Cette capacité du neurone à modifier ses propriétés fonctionelles et structurales est appelée la plasticité neuronale. En fait, les vésicules sont immobiles, en attente d’un signal « ready-to-go » qui survient lorsqu’il y a intense stimulation du neurone, ce qui déclenche l’endocytose.
Finalement, nous avons revisité tout ce concept d’endocytose au niveau de l’axone pour montrer qu’il y a bien de l’endocytose et qu’elle n’est pas constitutive mais finement régulée par l’activité du neurone.
Avez-vous fait appel aux plateformes technologiques**** de l’Institut de Myologie et si oui, à quel niveau des travaux ?
Effectivement, nous avons eu recours à l’expertise des équipes de l’institut. En particulier la plateforme MyoVector, dirigée par Sofia Benkhelifa-Ziyyat, nous a permis de faire des vecteurs AAV pour casser les spectrines dans les neurones. Gilles Moulay, qui dirige la plateforme MyoMolBio, a conçu et produit les outils de shRNA (utilisés pour casser une séquence) qui ont été intégrées dans les vecteurs. Par ailleurs, Jeanne Lainé, experte en microscopie électronique, a également beaucoup travaillé sur les neurones.
Quelles sont les perspectives ouvertes par ces travaux ?
Du point de vue technologique, cette découverte de la possibilité de combiner la microscopie photonique et électronique pour observer des neurones est unique au monde et offre, outre des images magnifiques, l’occasion d’observer, de comparer, de visualiser des phénomènes à l’échelle nanométrique pour mieux les décrypter. Nous avons combiné deux techniques exceptionnelles pour créer une valeur ajoutée qui va au-delà de la somme des deux !
Du point de vue scientifique, cette découverte nous a permis de comprendre un mécanisme qui pourrait être défectueux dans des myopathies. En effet, dans les cellules musculaires, la clathrine a des propriétés différentes et ne forme pas des vésicules comme dans l’axone mais des plaques. Cela étant, la compréhension de cette interaction entre les spectrines et les clathrines au niveau du neurone nous permet d’ouvrir de nouvelles pistes pour comprendre les pathologies neuromusculaires et d’envisager des possibilités d’intervention thérapeutique inédites.
________
** Notre laboratoire a développé une technique de microscopie électronique qui permet de visualiser les protéines de la surface interne de la cellule. Ce procédé consiste à casser la cellule par ultrasons, puis créer une réplique de la surface avec des grains de platine afin de pouvoir l’observer avec le microscope électronique. Grâce à la résolution nanométrique, il est ainsi possible d’observer les structures formées par les protéines en entier.
**** https://www.institut-myologie.org/expertises/plateformes-unites-technologiques/
