Fabien Le Grand dirige depuis mars 2015 le groupe « Régénération, physiologie et thérapies » au sein de l’équipe de Vincent Mouly au Centre de Recherche en Myologie.
Fabien Le Grand dirige depuis mars 2015 le groupe « Régénération, physiologie et thérapies » au sein de l’équipe de Vincent Mouly au Centre de Recherche en Myologie.
Il publie avec son équipe un article* dans Cell Reports portant sur l’impact de l’activation de la voie de signalisation Wnt/bêta-caténine dans les progéniteurs musculaires adultes.
Quel était votre objectif en entamant ce travail ?
On sait depuis longtemps que les signaux Wnt dits canoniques (qui activent la voie dépendante de la bêta-caténine) sont activés au cours de la régénération des tissus et qu’ils sont trop exprimés dans les muscles atteints de DMD, de FSH et dans le muscle âgé.
Le travail qui vient d’être publié a été mené pour comprendre ce que l’activation de cette voie engendre au sein des cellules souches musculaires (MuSCs) et de leurs descendants, les progéniteurs du muscle adulte.
Et qu’en avez-vous conclu ?
Notre conclusion est qu’il ne faut ni trop, ni trop peu d’activation (Goldilocks principle) ! A la suite d’une lésion, les MuSCs vont sortir de l’état de quiescence et proliférer pour donner naissance à des progéniteurs musculaires. Dans ces cellules, la signalisation Wnt/bêta-caténine va être activée et va contrôler de façon précise la balance entre prolifération et différenciation, elle doit être « bien » régulée pour que le tissu musculaire puisse se régénérer suite à une blessure.
Comment en avez-vous fait la démonstration ?
Nous avons pour cela généré des modèles génétiques conditionnels pour moduler la voie Wnt/bêta-caténine uniquement dans les MuSCs et nous avons analysé la régénération du tissu musculaire de ces souris mutantes.
Si l’on active génétiquement la bêta-caténine dans les progéniteurs issus de MuSCs, ceux-ci se différencient trop vite et le muscle se régénère mal. En effet les cellules n’ont alors pas le temps suffisant pour s’amplifier correctement et fusionnent trop vite. Le muscle régénéré est alors composé de petites fibres et le tissu montre des signes de vieillissement prématuré. A l’inverse, si l’on inhibe la voie de signalisation Wnt en cassant le gène codant pour bêta-caténine, les progéniteurs issus des MuSCs ne réussissent pas à se différencier au bon moment, ce qui entraine également une régénération incorrecte du muscle. Nous en concluons que voie Wnt influence le destin cellulaire en contrôlant de façon temporelle l’arrêt de la prolifération et le début de la différenciation des cellules réparatrices du muscle.
Quelles seront les prochaines étapes ?
Nous allons utiliser des petites molécules qui ciblent la voie de signalisation Wnt pour la diminuer dans les modèles murins de la myopathie de Duchenne afin d’améliorer l’état du muscle malade en activant la régénération endogène et en limitant la fibrose. Ainsi, en améliorant la santé du muscle d’un patient, on le prépare à recevoir un traitement de thérapie génique puisque l’un des gros obstacles à ce type de thérapie est précisément l’état du muscle malade.
Concrètement, nous allons collaborer avec Stéphanie Lorain (équipe 5 du centre de Recherche) qui travaille sur le maintien des génomes AAV dans les muscles dystrophiques. En effet, lorsque la fibre est endommagée (fibrose, inflammation, etc.), le vecteur ne se maintient pas et l’expression du vecteur thérapeutique disparaît progressivement. Nous allons donc essayer de réduire l’activation de la voie en testant, par exemple, des inhibiteurs de porcupine, la protéine responsable de la sécrétion des Wnts (déjà utilisés en cancérologie). Une fois que nous aurons obtenu l’effet recherché chez la souris modèle, nous réaliserons des tests sur des cellules de patients atteints de myopathie de Duchenne et sur des lignées de cellules immortalisées provenant de la plateforme de Vincent Mouly. Notre but est de rétablir le « bon niveau » de la signalisation Wnt/bêta-caténine dans les cellules dystrophiques afin d’améliorer leur potentiel réparateur.
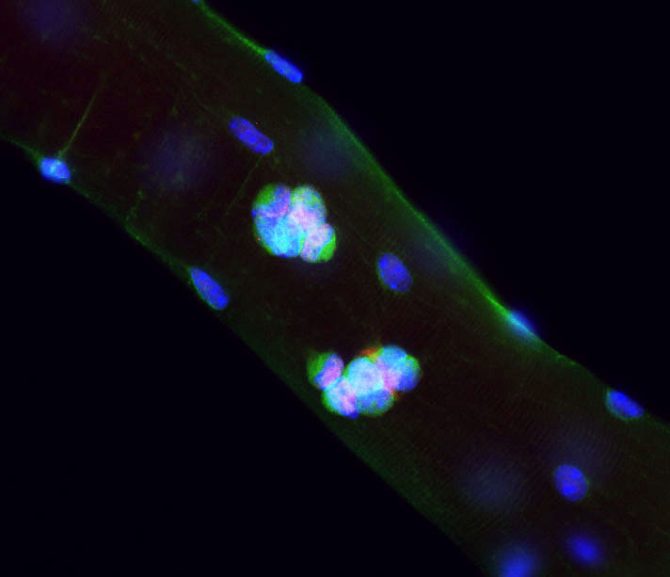
Figure (1) Myofibre
Les cellules souches musculaires situées autour des myofibres peuvent s’activer et donner naissances à des clones de cellules progénitrices. Ici, une myofibre intacte a été prélevée et mise en culture pendant 3 jours. Les progéniteurs issus des cellules souches expriment le facteur de transcription Pax7 (rouge) et la protein de surface Vangl2 (Vert).
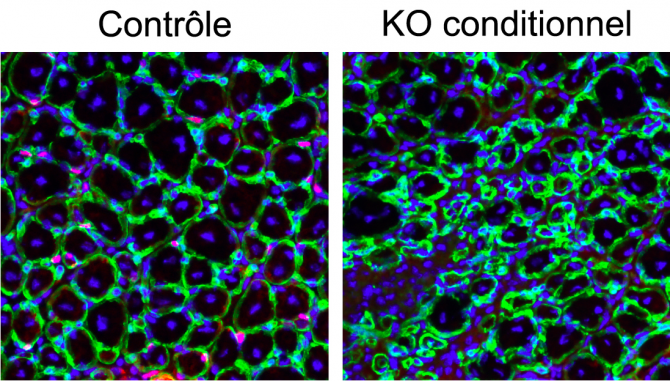
Figure (2) Régénération
La régénération du tissue musculaire a été induite par l’injection de cardiotoxin. Après 7 jours, les muscles ont été prélevés et des coupes transversales ont été réalisées. En condition contrôle, les progéniteurs musculaires ont pu reconstruire de nouvelles myofibres, entourées de lame basale (vert) comprenant des noyaux centraux (bleu). En revanche, lorsque l’expression de la bêta-caténine est génétiquement inhibée dans les cellules souches du muscle, le tissus ne se reconstruit pas normalement.